Quimica
9.952 Trabalhos sobre Exatas. Documentos 4.021 - 4.050
-
ETA - Estação de tratamento de água
Do dia 19 a 21 de outubro aconteceu a CIENTEC (Semana de Ciência, Tecnologia e Cultura da UFRN), nesta ocasião tive a oportunidade de assistir à apresentação de um aluno de química que estava no estande do PET (Programa de Educação Tutorial). O trabalho apresentado falava sobre o Tratamento da Água Para Consumo. A seguir as etapas do tratamento demonstradas no trabalho. Captação da água: a água vem de reservatórios naturais existentes, como rios, mananciais
Avaliação:Tamanho do trabalho: 1.068 Palavras / 5 PáginasData: 30/10/2016 -

Etanol
O principal agente do álcool é o etanol (álcool etílico). O consumo do álcool é antigo, bebidas como vinho e cerveja possuíam conteúdo alcoólico baixo, uma vez que passavam pelo processo de fermentação. Outros tipos de bebidas alcoólicas apareceram depois, com o processo de destilação. Apesar de o álcool possuir grande aceitação social e seu consumo ser estimulado pela sociedade, ele é uma droga psicotrópica que atua no sistema nervoso central, podendo causar dependência e
Avaliação:Tamanho do trabalho: 441 Palavras / 2 PáginasData: 7/4/2014 -

ETANOL
UNIP-UNIVERSIDADE PAULISTA CAMPUS ALPHAVILLE CURSO DE CIÊNCIA DA COMPUTAÇÃO ATIVIDADES PRÁTICAS SUPERVISIONADAS TEMA: ETANOL Santana de Parnaíba 2014 Etanol como fonte sustentável Santana de Paranaíba 2014 ÍNDICE Sumário Objetivo do Trabalho 04 Objetivo do trabalho 04 Introdução 05 Tema 06 Dissertação 12 Projeto do Site Relatório de Códigos Bibliografia 26 Ficha de Atividades Práticas Supervisionadas OBJETIVO DO TRABALHO A motivação para a elaboração deste trabalho se dá no desenvolvimento de aptidões em relação ao
Avaliação:Tamanho do trabalho: 8.935 Palavras / 36 PáginasData: 5/10/2014 -

Etanol
Etanol Produzido através da fermentação de amido e de outros açúcares, em especial da cana-de-açúcar, o etanol, também chamado de álcool etílico, é um biocombustível altamente inflamável e incolor, sendo muito utilizado em automóveis. Essa substância é renovável, pois sua matéria-prima é obtida através de plantas cultivadas pelo homem. Processo de obtenção do etanol a partir do milho O etanol é produzido a partir de milho como uma biomassa industrial através de fermentação, destilação e
Avaliação:Tamanho do trabalho: 1.539 Palavras / 7 PáginasData: 20/10/2014 -
ETANOL À BASE DE INHAME (COLOCASIA ESCULENTA)
FIEG SENAI.jpg FACULDADE DE TECNOLOGIA SENAI ROBERTO MANGE ANA LUIZA DA SILVA MOREIRA GIOVANNA DA SILVA PEREIRA LARISSA DO NASCIMENTO REIS LIVYA EMANUELLY SILVA DE JESUS LORRANY ALVES DE ASSIS ETANOL À BASE DE INHAME (COLOCASIA ESCULENTA) Anápolis 2016 ANA LUIZA DA SILVA MOREIRA GIOVANNA DA SILVA PEREIRA LARISSA DO NASCIMENTO REIS LIVYA EMANUELLY SILVA DE JESUS LORRANY ALVES DE ASSIS ETANOL À BASE DE INHAME (COLOCASIA ESCULENTA) Trabalho de conclusão de curso apresentado à
Avaliação:Tamanho do trabalho: 5.791 Palavras / 24 PáginasData: 14/11/2017 -
Etanol de sorgo sacarino
INTRODUÇÃO Enquanto vivemos em uma crise energética pelo elevado preço do petróleo, muitos pesquisadores buscam fontes alternativas como meio para a produção de energias como a eletricidade e o calor. Grande é a procura e pesquisa para recursos viáveis à produção de energias renováveis. Hoje em dia, o etanol tem sido considerado uma importante fonte de energia alternativa para o futuro, pois é ambientalmente sustentável. As matérias orgânicas utilizadas para produção dessas energias é a
Avaliação:Tamanho do trabalho: 8.967 Palavras / 36 PáginasData: 2/11/2015 -

Etanol hidratado
Etanol hidratado (etanol comum)--Nos postos de combustível, o álcool hidratado é aquele vendido como etanol comum, ou apenas etanol. Esse é o mesmo tipo de álcool utilizado na produção de bebidas, alimentos, cosméticos, aromatizantes, produtos de limpeza, remédios, vacinas, entre outros produtos, mudando nesses casos o processo de pós-fabricação. No Brasil, ele é feito principalmente através da fermentação da cana-de-açúcar (processo em que as moléculas de açúcar da cana são transformadas, com a ação de
Avaliação:Tamanho do trabalho: 1.181 Palavras / 5 PáginasData: 9/8/2014 -

Etanol, descrição do processo
2 RELATÓRIO TÉCNICO – EXPERIMENTO DOS AVIÕES DE PAPEL BRUNO SILVEIRA, GABRIELA ALMEIDA, MARIANA S. OLIVEIRA, MILENA OLIVEIRA, THAIS PAZ DIADEMA, SP 06/2017 ________________ BRUNO SILVEIRA, GABRIELA ALMEIDA, MARIANA S. OLIVEIRA, MILENA OLIVEIRA, THAIS PAZ RELATÓRIO TÉCNICO – EXPERIMENTO DOS AVIÕES DE PAPEL Experimento realizado como parte da programação da unidade curricular Metodologia Científica do curso de Graduação da Universidade Federal de São Paulo. Orientador: Werner Hanisch DIADEMA, SP 05/2017 RESUMO Como forma de inovação
Avaliação:Tamanho do trabalho: 3.374 Palavras / 14 PáginasData: 15/9/2017 -

Etapas da análise granulométrica
PONTIFÍCIA UNIVERSIDADE CATÓLICA DE GOIÁS DEPARTAMENTO DE ENGENHARIA CURSO DE ENGENHARIA CIVIL RELATÓRIO TÉCNICO ENSAIOS DE LABORATÓRIO CARACTERIZAÇÃO DO MATERIAL Discentes GOIÂNIA-GO 2014 RESUMO O resumo deve citar todas as partes do trabalho, como: introdução (objetivo), metodologia, resultados e conclusões. Palavras-chave: Análise Granulométrica. Massa específica real dos grãos. Índices de Consistência. Limite de plasticidade. Limite de liquidez. introdução Além de introduzir os assuntos, devem-se também colocar os objetivos do estudo. Materiais e métodos Preparação das
Avaliação:Tamanho do trabalho: 2.392 Palavras / 10 PáginasData: 10/10/2014 -

Etapas de conversão de resina de PET em garrafas, latas ou potes
Qual é o ciclo de vida de uma garrafa pet ? Atualmente o mercado de embalagens apresenta grande evolução, isto ocorre porque a escolha das embalagens, que são utilizadas em diversos produtos, considera também a busca por tecnologias mais limpas, e não só os custos e a preferência do consumidor. Para gerenciar a escolha de embalagens que afetem menos o meio ambiente é utilizada a Avaliação de Ciclo de Vida. Esta ferramenta permite medir os
Avaliação:Tamanho do trabalho: 1.228 Palavras / 5 PáginasData: 22/10/2014 -

Etapas do processo de deposição
precipitação é a formação de um sólido durante a reação química. O sólido formado na reação química é chamado de precipitado. Isso pode ocorrer quando a substância insolúvel, o precipitado, é formado na solução devido a reação química ou quando a solução foi super saturada por um composto. A formação do precipitado é um sinal de mudança química. Na maioria das vezes, o sólido formado "cai" da fase, e se deposita no fundo da solução
Avaliação:Tamanho do trabalho: 390 Palavras / 2 PáginasData: 8/10/2014 -
Etapas para um projeto de pesquisa
LICENCIATURA EM QUÍMICA SEMINÁRIO Aluno(a): Marcos Tayrone dos Santos Orientador(a): Professor Me. Geraldo Alexandre Júnior QUALIFICAÇÃO DO PROJETO DE PESQUISA TÍTULO PROVISÓRIO: O ensino da argumentação: uma contribuição para o ensino de conteúdos atitudinais frente a questões sociocientíficas no ensino de ciências. OBJETIVO GERAL: Analisar como uma proposta envolvendo o uso da argumentação no ensino de ciências pode contribuir para o desenvolvimento de conteúdos atitudinais dentro de um ambiente que envolve questões sócio científicas. INTRODUÇÃO:
Avaliação:Tamanho do trabalho: 661 Palavras / 3 PáginasData: 17/11/2016 -

Eter
Nome segundo IUPAC Nome da cadeia mais simples (prefixo + oxi) + nome da cadeia mais complexa (prefixo + infixo + o) Ex.: metoxietano O infixo indica o tipo de ligação: Se for somente simples usa-se "an". Se tiver um dupla ligação, usa-se "en". Se houver um tripla ligação, usa-se "in" Usual Éter + mais simples + Nome do radical mais complexo + ico Os éteres pouco complexos são nomeados considerando-se que uma das partes
Avaliação:Tamanho do trabalho: 444 Palavras / 2 PáginasData: 7/7/2014 -

Éteres
Éteres são compostos orgânicos que apresentam o grupo funcional - O- (oxigênio) entre dois radicais (carbonos), ou seja, se caracterizam pela presença de oxigênio ligado a dois átomos de carbono. Características físicas dos éteres: no estado líquido são muito voláteis, incolores e de cheiro agradável, não apresentam solubilidade em água, mas podem ser encontrados também na fase sólida ou gasosa. Para saber o estado físico de um éter é só observar a quantidade de carbonos:
Avaliação:Tamanho do trabalho: 242 Palavras / 1 PáginasData: 8/11/2014 -

Éteres
Os éteres são substâncias que tem dois grupos orgânicos ligados ao mesmo átomo de oxigênio Os grupos orgânicos podem ser alquila, arila ou vinila e o átomo de oxigênio pode fazer parte de uma cadeia linear ou de um anel. Têm fórmula geral R-O-R, quando os dois grupos orgânicos são idênticos e são chamados de éteres simétricos. Podemos também ter fórmula geral R-O-R, quando os dois grupos orgânicos são diferentes e são chamados de éteres
Avaliação:Tamanho do trabalho: 916 Palavras / 4 PáginasData: 4/12/2014 -
Éteres Coroas
Éteres coroas * Histórico Descoberto em 1967 por Charles Pedersen que trabalhava na empresa DuPont, e recebeu o Premio Nobel de Química em 1987. A descoberta foi feita acidentalmente quando tentava preparar um agente complexante para cátions divalentes. Assim, havia descoberto uma nova classe de compostos, os poliéteres cíclicos, que apresentavam grande eficiência para complexar cátions, transporte de cátions de metais alcalinos e alcalinos terrosos. * Nomenclatura Pedersen introduziu um nome que compreendia o tamanho
Avaliação:Tamanho do trabalho: 452 Palavras / 2 PáginasData: 26/4/2016 -
Ética e Questões Ambientais: Necessitamos de um “Contrato Natural”?
Ética e questões ambientais: necessitamos de um “contrato natural”?[1] No século XX, a humanidade passou a se preocupar cada vez mais com a preservação dos recursos naturais e as questões ambientais em geral. Segundo o filósofo Bruno Latour, um problema ecológico é um híbrido, pois não envolve apenas uma ciência ou um conjunto de ciências; tem também um aspecto político. Por essa razão, Latour fala em “políticas da natureza”: já não basta produzir uma ciência,
Avaliação:Tamanho do trabalho: 644 Palavras / 3 PáginasData: 29/8/2016 -
Ética e Sociedade no Mundo Globalizado e Ética em Saúde
VIDEO – DICA DO PROFESSOR - 3 - Ética e Sociedade no mundo globalizado e Ética em Saúde Principais pontos que guiam a ética em saúde, você estudará o princípio de respeito à autonomia do paciente que se aplica na prática com o uso do consentimento esclarecido. A autonomia é um direito de todas as pessoas tomarem suas próprias decisões, quando elas dizem a respeito de sua própria vida. Esse direito deve ser respeitado pelos
Avaliação:Tamanho do trabalho: 518 Palavras / 3 PáginasData: 28/3/2019 -
Etica laboratorial
Logo vazado.png C:\Users\Mari\Documents\ELGUERO\Outros docs\Lauburu + nome.PNG MANUAL DE ÉTICA E CONDUTA INTERNA Fazenda Elguero & Instituto Manacá O Manual de Ética e Conduta Interna tem por objetivo oferecer uma compreensão clara sobre as condutas que orientam nosso trabalho e nosso relacionamento, devendo estar presentes no dia-a-dia das atividades realizadas junto a Fazenda Elguero e o Instituto Manacá. O comprometimento com essas diretrizes é condição essencial para o bom desenvolvimento do trabalho em conjunto. O presente
Avaliação:Tamanho do trabalho: 699 Palavras / 3 PáginasData: 20/9/2015 -

Evaporação
Evaporação: é usado para separação de misturas homogêneas constituída de um componente sólido e o outro líquido. A evaporação é usada para separar misturas, quando apenas a fase sólida é de interesse. O sal de cozinha é extraído da água do mar por evaporação. A água do mar é represada em grandes tanques, de pequena profundidade, construídos na areia, chamados de salinas. Sob a ação do sol e dos ventos a água do mar represada
Avaliação:Tamanho do trabalho: 368 Palavras / 2 PáginasData: 28/9/2014 -

Eventos: aromatizatorı e aromas
Ésteres: Sabores e Fragrâncias Ésteres são uma das classes de substâncias químicas largamente encontrada na natureza. Os ésteres mais simples tendem a apresentar odores agradáveis. Em mitos casos, os sabores e fragrâncias característicos de flores e frutas devem-se que apresenta a função éster em sua estrutura. Uma exceção importante são os óleos essenciais. As qualidades organolépticas (sabores e odores) de frutas e flores devem-se, freqüentemente, a misturas complexas nas quais predomina um éster. Alguns dos
Avaliação:Tamanho do trabalho: 204 Palavras / 1 PáginasData: 11/11/2014 -

Evidência de reações químicas
Universidade de Uberaba Engenharia Química Amanda Michelle Leite Tavares Gustavo Torres Fernandes Teixeira José Vaz Pinheiro Neto Paulo Augusto Maia Barbosa Thainá Kuetlin Silva Ferreira Thamara Stefany Rodrigues Pereira Welisson Martins Rocha Evidência de Reações Químicas Uberaba – MG 08/2014 Resumo Foi realizado no dia 03 de setembro de 2014, na Universidade de Uberaba o experimento chamado Síntese do Cloreto de hidrogênio, onde em um kitassato colocou – se 40g de cloreto de sódio e
Avaliação:Tamanho do trabalho: 518 Palavras / 3 PáginasData: 13/9/2014 -

Evidência química
Evidências Químicas A descoberta de envidências químicas foi a partir de mudanças , aparecimento de substâncias diferentes das que existiam antes. As substâncias quando reagem , as vezes, ocorrem fatos bastantes visíveis que confirmam a ocorrencia da reação onde pode-se destacar : desprendimento de gás e luz , mudança de coloração e cheiro , formação de precipitados , etc . O cientista Lavoisier ao perceber estas mudanças começou a analisar duas experiências e tirar algumas
Avaliação:Tamanho do trabalho: 723 Palavras / 3 PáginasData: 5/4/2014 -
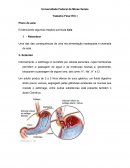
Evidenciando Algumas Reações Químicas: Azia
Universidade Federal de Minas Gerais Trabalho Final ITIC I Plano de aula: Evidenciando algumas reações químicas:Azia 1. - Relembrar Uma das das consequências de uma má alimentação inadequada é chamada de azia. 2- Entender Internamente, o estômago é revestido por células parientais, cujas membranas permitem a passagem de água e de moléculas neutras e, geralmente, bloqueiam a passagem de alguns íons, tais como: H+, Na+, K+ e Cl-. Um adulto produz de 2 a 3
Avaliação:Tamanho do trabalho: 556 Palavras / 3 PáginasData: 14/8/2019 -
EVIDÊNCIAS DA OCORRÊNCIA DE REAÇÕES QUÍMICAS
EVIDÊNCIAS DA OCORRÊNCIA DE REAÇÕES QUÍMICAS Clissia Manuella Azevedo Fernanda Lourido Xavier João Lucas Brasil de Medeiros Kamila Vitória Catão de Deus Stefany Caroline Ferreira dos Santos Vitória Magno Leão Silva RESUMO O presente artigo teve como finalidade estudar as evidências de algumas reações químicas realizadas em laboratório. Foram realizados quatro experimentos; no primeiro, misturou-se uma quantidade de CuSO4 com NHCO3, ambos em estado físico aquoso, ocorrendo algumas das evidências de uma reação química, a
Avaliação:Tamanho do trabalho: 1.239 Palavras / 5 PáginasData: 3/9/2018 -
Evidências de Reações Químicas
CURSO: TÉCNICO EM QUÍMICA Disciplina: Química Geral Professor: Vladimir Guedes EVIDÊNCIAS DE REAÇÕES QUÍMICAS Integrantes do grupo: Afonso Henrique Machado Carlos Cesar de Souza Madeira César Henrique Cavalaro Atibaia - Setembro de 2014 1 – INTRODUÇÃO A matéria encontra-se em transformação permanente na natureza. Sob a ação de agentes, a matéria pode sofrer alterações em seu estado físico ou químico. Uma transformação física não altera a identidade da substância ou matéria, a exemplo das mudanças
Avaliação:Tamanho do trabalho: 16.713 Palavras / 67 PáginasData: 31/5/2015 -
Evidências de Reações Químicas
Universidade Federal do Ceará Centro de Ciências Departamento de Química Orgânica e Inorgânica Prática nº 4 EVIDÊNCIA DE REAÇÕES QUÍMICAS Aluno: Lorena Monique Barbosa Rodrigues Curso: Química - Bacharelado Matrícula: 353969 Prof.: Dr.ª Izaura Diógenes Fortaleza, 20/06/2013 ________________ OBJETIVOS 1. Verificar se houve reações químicas através dos resultados dos procedimentos experimentais. 2. Identificar os diferentes tipos de precipitados. 3. Utilizar as propriedades químicas de um composto para identificá-lo. ________________ INTRODUÇÃO ________________ PROCEDIMENTO EXPERIMENTAL PARTE A:
Avaliação:Tamanho do trabalho: 2.115 Palavras / 9 PáginasData: 4/7/2016 -
EVOLUÇÃO DA LEGISLAÇÃO DE SEGURANÇA DO TRABALHO NO MUNDO E NO BRASIL
UNIVERSIDADE DO GRANDE RIO PROF. JOSÉ DE SOUZA HERDY RAYANE KLEM DO NASCIMENTO EVOLUÇÃO DA LEGISLAÇÃO DE SEGURANÇA DO TRABALHO NO MUNDO E NO BRASIL RAYANE KLEM DO NASCIMENTO Evolução da legislação de segurança do trabalho no mundo e no Brasil ________________ Sumário 1. INTRODUÇÃO 3 2. IMPORTÂNCIA DA SEGURANÇA DO TRABALHO 4 2.1 Aspectos sociais 4 2.2 Aspectos humanos 4 2.3 Aspectos econômicos 4 3. A EVOLUÇÃO DA SEGURANÇA DO TRABALHO NO MUNDO 4
Avaliação:Tamanho do trabalho: 1.202 Palavras / 5 PáginasData: 6/3/2019 -
Evolução das Leis da Ciencia
1. Evolução e as leis da ciência: as leis da termodinâmica A maioria dos livros didáticos afirma que: "[O]s princípios da termodinâmica existem desde a criação do universo". Grande parte da tecnologia de engenharia disponíveis hoje é baseada nas verdades fundamentais consagrados nas leis da Termodinâmica. Porém, estas leis têm aplicação para o debate criação/evolução como alguns pesquisadores sugerem? O que eles realmente dizem e querem dizer? A palavra “Termodinâmica” vem de duas palavras gregas:
Avaliação:Tamanho do trabalho: 3.897 Palavras / 16 PáginasData: 15/7/2016 -

EVOLUÇÃO DE MODELOS NUCLEARES: DDTRB
Quimica átomo= menor partícula existente de um elemento EVOLUÇÃO DOS MODELOS ATÔMICOS: DDTRB(iniciais) Demócrito (toda matéria é formada por átomo) Dalton (bola de bilhar-densa) Thompson (pudim de passas- bolha positiva gelatinosa com eletrons suspensos) *investigou os raios catódicos: após voltagem um sinal luminoso saia do catodo p/ anodo Ruthenford (densa carga positiva central, núcleo, com eletrons ao redor PARADOS) Obs: ele quase definiu o modelo, só errou por afirmar que os eletrons ficavam parados Bohr
Avaliação:Tamanho do trabalho: 202 Palavras / 1 PáginasData: 17/8/2014